Межмолекулярные силы притяжения - это важное явление в химии и физике, связанное с взаимодействием атомов и молекул друг с другом. Помимо сил притяжения, существуют также межмолекулярные силы отталкивания, однако силы притяжения обладают большей значимостью, так как благодаря им возможно образование устойчивых химических соединений и существование различных агрегатных состояний вещества.
Существует несколько типов межмолекулярных сил притяжения, основными из которых являются дисперсные силы, диполь-дипольные силы и водородные связи. Дисперсные силы возникают в результате кратковременного результирующего диполя, вызванного несимметрией зарядов в атоме или молекуле. Диполь-дипольные силы возникают между молекулами, у которых есть постоянный дипольный момент, то есть разъединенные положительный и отрицательный заряды. Водородные связи возникают между молекулами, в состав которых входят атомы водорода, привлекаемые к электроотрицательным атомам.
Причины возникновения межмолекулярных сил притяжения заключаются в основных свойствах атомов, молекул и компонентов веществ. Одной из них является электрический заряд, который может быть положительным или отрицательным. Заряды притягиваются друг к другу и создают силы притяжения. Возникновение дисперсных сил притяжения связано с мгновенной перераспределением электронов в атоме или молекуле, что приводит к образованию временных диполей. Эти диполи взаимодействуют с диполями соседних молекул, что приводит к силам притяжения. Водородные связи обусловлены особым строением и возможностью привлечения атомов водорода к электроотрицательным атомам других молекул. Диполь-дипольные силы заключаются в притяжении молекул друг к другу посредством дипольных моментов.
Пространственная ориентация и дипольные силы
Для того чтобы понять происхождение и причины возникновения дипольных сил, необходимо рассмотреть молекулярную структуру и ориентацию молекул в пространстве. Молекулы могут быть полярными или неполярными. Полярные молекулы имеют разделение зарядов внутри своей структуры, обусловленное разной электроотрицательностью атомов, из которых они состоят.
Дипольные силы притяжения возникают между полярными молекулами из-за разности электрических зарядов. Положительный полюс одной молекулы притягивается к отрицательному полюсу другой молекулы, что создает слабое электростатическое притяжение между ними.
| Тип межмолекулярной силы | Полярность молекул |
|---|---|
| Дипольные силы | Полярные молекулы |
| Дисперсионные силы (силы Лондонова) | Неполярные молекулы |
| Ионно-дипольные силы | Полярные и ионные молекулы |
Неполярные молекулы не имеют разделения зарядов, и поэтому притяжение между ними происходит за счет дисперсионных сил (сил Лондонова). Дисперсионные силы возникают в результате временного изменения электронной плотности вокруг атомов или молекул.
Ионно-дипольные силы возникают между полярными или ионными молекулами. В таких случаях, положительно заряженный ион притягивается к отрицательно заряженному полюсу полярной молекулы. Это создает дополнительное электростатическое притяжение между ними.
Таким образом, происхождение и причины возникновения дипольных сил притяжения связаны с пространственной ориентацией молекул и их полярностью. Полярные молекулы обладают разделением зарядов, что приводит к возникновению дипольных сил притяжения. В случае неполярных молекул, силы притяжения возникают за счет дисперсионных сил (сил Лондонова), вызванных временным изменением электронной плотности. Ионно-дипольные силы возникают между полярными или ионными молекулами.
Дисперсионные и положенные дипольные силы
Среди межмолекулярных сил притяжения особое место занимают дисперсионные и положенные дипольные силы. Эти силы возникают в результате взаимодействия неизменных и изменяемых диполей молекул.
Дисперсионные силы основаны на временном возникновении момента диполя в молекуле вследствие неравномерного распределения электронной плотности. Индуцированный момент диполя в молекуле вызывает индуцированный диполь в соседней молекуле и приводит к их взаимному притяжению. Дисперсионные силы являются наиболее слабыми, но прибавка к их силе возникает с увеличением числа электронов в молекуле и поверхности взаимодействия.
Положенные дипольные силы возникают в результате взаимодействия постоянных диполей молекул. В таком случае, одна молекула с постоянным диполем притягивает другую молекулу с таким же диполем. Эти силы существуют даже в немагнитных веществах и являются более сильными, чем дисперсионные силы.
Взаимодействие дисперсионных и положенных дипольных сил играет важную роль во многих физических и химических процессах, таких как образование жидкостей, сильно связанных силами Ван-дер-Ваальса, и взаимодействие молекулярных систем в разных состояниях.
Изучение дисперсионных и положенных дипольных сил позволяет углубить наши знания о межмолекулярных силах, их происхождении и причинах возникновения, а также найти практическое применение в различных областях науки и промышленности.
Ионные силы притяжения
Ионные силы притяжения играют важную роль во многих аспектах химии и физики. Они определяют свойства многих веществ, влияют на их растворимость и взаимодействие с другими веществами.
Ионные силы притяжения обусловлены электростатическим притяжением между положительными и отрицательными зарядами. Положительно заряженные ионы притягивают отрицательно заряженные ионы, образуя ионные связи.
Притяжение между ионами является сильным и может быть довольно долговременным. Это объясняет высокую температуру плавления и кипения у многих ионных соединений, таких как соли.
| Примеры ионных соединений | Катион | Анион |
|---|---|---|
| Натрий хлорид | Na+ | Cl- |
| Калий йодид | K+ | I- |
| Магний оксид | Mg2+ | O2- |
В конечном итоге, ионные силы притяжения играют важную роль в стабильности многих веществ и обладают большим влиянием на химические и физические свойства материалов. Их понимание существенно влияет на разработку новых материалов и процессов.
Гидрофильные и гидрофобные взаимодействия
В межмолекулярных силах притяжения особую роль играют гидрофильные и гидрофобные взаимодействия. Гидрофильные взаимодействия характерны для веществ, которые обладают способностью взаимодействовать с водой. Такие молекулы содержат полюсность или полярные группы, которые способны образовывать водородные связи с молекулами воды.
В результате гидрофильные вещества могут образовывать растворы с водой и растворяться в ней. Это объясняется тем, что между водой и гидрофильными молекулами возникают энергетически выгодные взаимодействия, которые позволяют им образовывать стабильные соединения.
В отличие от гидрофильных веществ, гидрофобные молекулы не обладают способностью взаимодействовать с водой. Они имеют неполярную структуру и не могут образовывать водородные связи с молекулами воды.
Поэтому гидрофобные вещества плохо растворимы в воде и склонны образовывать агрегаты в форме капелек или пузырьков, так как молекулы стремятся избегать контакта с водой. Гидрофобные взаимодействия имеют важное значение для образования клеточных мембран, где гидрофобные хвосты липидных молекул образуют двойные слои и обеспечивают проницаемость мембраны для гидрофобных молекул.
Ковалентные связи и ван-дер-Ваальсовы силы
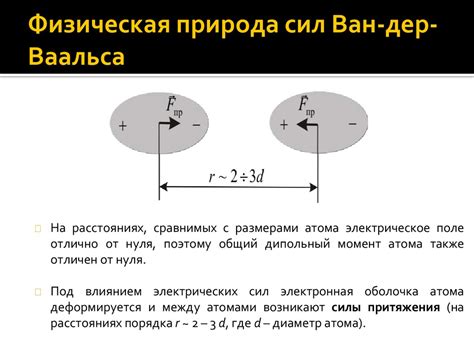
Ковалентная связь возникает между атомами при обмене электронами. Когда атомы вступают в ковалентную связь, их внешние электронные оболочки перекрываются, образуя общую оболочку. Такая связь обладает высокой прочностью и устойчивостью. Ковалентные связи характерны для большого числа органических и неорганических соединений и определяют их химические свойства и структуру.
Ван-дер-Ваальсовы силы – это слабые силы притяжения между молекулами, которые возникают в результате неравномерного распределения электронной плотности в молекулах. В отличие от ковалентных связей, ван-дер-Ваальсовы силы не приводят к образованию устойчивой связи между атомами, а представляют собой временное притяжение между молекулами. Ван-дер-Ваальсовы силы влияют на физические свойства вещества, такие как температура кипения, температура плавления и вязкость.
Таким образом, ковалентные связи и ван-дер-Ваальсовы силы играют важную роль в определении структуры и свойств вещества. Понимание этих сил притяжения позволяет объяснить различные физические и химические явления и используется в различных областях науки и техники.
Взаимодействие веществ в различных средах

Межмолекулярные силы притяжения играют важную роль во взаимодействии веществ в различных средах. В зависимости от характеристик среды, межмолекулярные силы могут проявляться по-разному и влиять на физические свойства вещества.
В газовой среде, межмолекулярные силы притяжения обычно слабо выражены. Взаимодействие между молекулами газов происходит в основном благодаря ван-дер-ваальсовым силам. Эти силы вызывают недолокальные изменения в электронной плотности молекулы, что приводит к появлению мгновенных диполей. Эти диполи взаимодействуют друг с другом, вызывая притяжение или отталкивание между молекулами. В результате, газы обладают высокой подвижностью и распределяются равномерно в пространстве.
В жидкостях межмолекулярные силы притяжения становятся более сильными. Частицы в жидкости находятся ближе друг к другу и взаимодействуют друг с другом более интенсивно. Это приводит к появлению сил взаимодействия, известных как дисперсионные силы или Лондоновские силы. Кроме того, в жидкостях могут присутствовать и другие типы межмолекулярных сил, такие как диполь-дипольные взаимодействия и водородные связи. Благодаря этим силам, жидкости обладают сжимаемостью и способностью к течению.
В твердых веществах межмолекулярные силы притяжения становятся еще более сильными. В твердых веществах частицы находятся очень близко друг к другу и сильно взаимодействуют между собой. Основные типы межмолекулярных сил в твердых веществах - ионные связи, ковалентные связи и металлические связи. Благодаря этим силам, твердые вещества обладают определенной формой, объемом и механической прочностью.
Таким образом, межмолекулярные силы притяжения определяют физические свойства вещества в различных средах. Различия в силе взаимодействия между молекулами влияют на такие характеристики, как плотность, температура плавления и вязкость. Понимание этих взаимодействий помогает в изучении свойств и поведения вещества в различных условиях.



